Nyheter
Curasight ingår partnerskap med Curium – kan erhålla 70 miljoner USD i milstolpar

Curasight, som är noterat på Spotlight, har ingått ett globalt partnerskap med Curium. Curasight kommer att utveckla sin egenutvecklade PET-bildteknik uTRACE för att erhålla myndighetsgodkännande i EU och USA, med Curium som ansvarig för tillverkning och kommersialisering.
Milstolpsbetalningar och tvåsiffriga royalties
Curasight kan få till upp till 70 miljoner USD i milstolpsbetalningar gällande utveckling och kommersialisering. Curasight är även berättigat till tvåsiffriga royalties på försäljningen vid eventuell kommersialisering. Avtalet avser prostatacancer.
Enligt det exklusiva och globala licens- och samarbetsavtalavtalet kommer Curasight att utveckla sin egenutvecklade uTRACE-teknologi för användning i prostatacancer fram till dess att myndighetsgodkännande beviljas i EU och USA. Curium kommer att ansvara för den kommersiella tillverkningen av uTRACE och den globala kommersialiseringen.
Curasight siktar på att positionera uTRACE som en förstklassig PET-tracer som kan fungera som ett alternativ eller komplement till traditionella biopsier för utvärdering av patienter med prostatacancer i aktiv övervakning. Curasight fick nyligen feedback från den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) vid ett pre-IND-möte om utvecklingsplanen för den [64]Cu-märkta versionen av uTRACE för användning vid prostatacancer.
”Vi är mycket glada över att underteckna detta partnerskap med Curium, som vi anser ger ytterligare validering av vår uTRACE[®]-plattform och dess användning i prostatacancer. Vårt samarbete kombinerar Curasights styrkor i utvecklingen av uTRACE[®] och Curiums beprövade expertis, kapacitet och globala meriter inom tillverkning och kommersialisering av radiofarmaka”, säger Curasights vd Ulrich Krasilnikoff. ”Det här partnerskapet stöder vidareutvecklingen av vår diagnostiska plattform och för oss närmare vår ambition att hjälpa ett stort antal prostatacancerpatienter.”
”Som global ledare inom nuklearmedicin är Curium engagerat i att utveckla livsviktiga diagnostik- och behandlingslösningar för cancerpatienter. Vi är glada över möjligheten att ytterligare utöka vår innovativa franchise för koppar-64-märkt PET-diagnostik inom en lovande indikation. Vårt partnerskap med Curasight kommer att utnyttja Curiums globala närvaro, Copper 64-expertis och expertis inom prostatacancer för att föra ut denna innovativa lösning till patienter och sjukvårdspersonal runt om i världen.” tillade Chaitanya Tatineni, Curiums Chief M&A Officer och chef för Curiums licens- och partnerskapsprogram.
Curasight behåller rättigheter utanför prostatacancer
uTRACE-plattformen är en del av Curasights uPAR teranostic-lösning, som består av dess uTRACE-diagnostikteknik och dess uTREAT-teknik för riktad behandling. Genom att visualisera cancern på ett förbättrat och intelligent sätt syftar uTRACE-plattformen till att ge en mer exakt diagnos i vissa typer av cancer, inklusive prostatacancer, vilket kan stödja en personlig behandlingslösning för varje patient. Tekniken har testats i flera kliniska fas 2-studier. Curasight kommer att behålla alla rättigheter att utveckla och kommersialisera uTRACE inom indikationer utanför prostatacancer.
Nyheter
Affärsvärlden delar ut en köprekommendation till Coor-aktien

Coor-aktien tappade på rapporten och Affärsvärlden skriver i en analys att bolaget har en del kvar att göra för att få upp lönsamheten till nivån de hade innan företaget tappade Ericsson-avtalet. Men man skriver vidare att marknadens förväntningar på att bolaget ska lyckas är allt för låga och delar ut en köprekommendation.
Analystjänsten skriver att Coor, liksom branschen, idag värderas till 10 gånger innevarande års väntade rörelsevinster.
”Detta är lägre än tidigare men vi har använt detta som multipel på Coors vinstförmåga i slutet av vår horisont. Våra prognoser är lite försiktigare än konsensus både för omsättning (cirka 5 procents tillväxt enligt konsensus) och marginal (5,5 procent 2026E). Våra antaganden ger en uppsida på cirka 30 procent”
Affärsvärlden varnar dock för att även nästa kvartal kan bli svagt. ”Men blickar man mot nästa år och framöver är dock förväntningarna lågt ställda tycker vi”
Coor-aktien gick igår upp 0,79 procent och stängde på 43,50 kronor.
Nyheter
Big Akwa bekräftar planer på en framtida IPO

Biq Akwa, som grundats av Elena Petukhovskaya och Hugo Wikström, vill driva storskalig landbaserad fiskodling. Ett stort fokus för bolaget är att så mycket som möjligt ska återanvändas, vilket även inkluderar att odlingen ska ske i anslutning till massafabrik för att kunna använda och cirkulera varandras strömmar.
Den första anläggningen som Big Akwa designar ska producera 6 000 ton regnbågslax per år. För sin första fas har bolaget tagit in ett mindre antal miljoner kronor i kapital. Men för att bygga en stor anläggning krävs självklart rejält med finansiering.
Big Akwa söker nu en CFO som kan hjälpa företaget med resan och där bekräftar man även att en börsnotering finns i planerna inom 5 år.
Nyheter
Saab får en beställning på 6,6 miljarder kronor för leverans under 2027-2028

Saab har idag tagit fått en beställning på ett antal försvarssystem och materiel från en regeringen i ett land i västvärlden. Ordervärdet är cirka 6,6 miljarder kronor och leveranser är planerade år 2027-2028.
Beställningen omfattar system och materiel från Saabs affärsområden Dynamics och Surveillance.
På grund av branschens karaktär och omständigheter som rör kunden samt nationella säkerhetsintressen kommer ingen ytterligare information om denna beställning eller kunden att offentliggöras skriver Saab.
-

 Nyheter2 månader sedan
Nyheter2 månader sedanIngen större anledning att investera i Betsson för tillfället anser Börsveckan
-

 Nyheter2 månader sedan
Nyheter2 månader sedanHär är aktierna du ska äga under sommaren 2024 enligt Dagens industri
-

 Nyheter1 månad sedan
Nyheter1 månad sedanVärldens mest prisbelönta gintillverkare noteras på First North
-

 Nyheter2 månader sedan
Nyheter2 månader sedanBörsveckan ger en köprekommendation till det danska cigarrbolaget med en direktavkastning på 9 procent
-

 Nyheter4 veckor sedan
Nyheter4 veckor sedanFractal Gaming Group är tillbaka på noteringskursen, aktien är köpvärd anser Börsveckan
-

 Nyheter1 månad sedan
Nyheter1 månad sedanIngående intervju med SBB:s VD Leiv Synnes
-
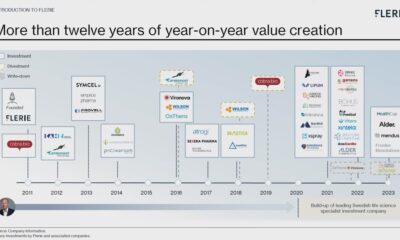
 Nyheter1 månad sedan
Nyheter1 månad sedanFlerie, investmentbolaget inom life science som är nytt på börsen
-

 Nyheter6 dagar sedan
Nyheter6 dagar sedan10 bra aktier för Greklands ekonomiska boom